小鼠胚胎中最早能识别的PGCs位于原条后端。研究表明,小鼠中存在一个综合的调控程序在时间和空间上限制生殖系能力(germlinecompetence),进而通过响应BMP信号产生约30个前体PGCs(PGCsfounder)【3】。然而在妊娠2-3周左右研究新生人类PGCs(hPGC)在伦理和技术上都是无法实现的,因此主要依靠小鼠及体外模型来探究驱动hPGC发育的分子机制。研究人员从小鼠中鉴定了与hPGC命运相关的转录因子网络,其中SOX17是hPGC命运的关键调控因子【4】。除了SOX17外,PRDM1(orBLIMP1)和TFAP2C对hPGC命运也至关重要【5-6】,它们的表达和功能在体内的迁移和性腺生殖细胞中继续存在。阐释这些转录因子如何促进hPGC分化和成熟对于理解生殖细胞的发育至关重要。
近日,来自英国剑桥大学的团队在NatureCellBiology杂志上在线发表了题为Sequentialenhancerstateremodellingdefineshumangermlinecompetenceandspecification的文章,通过体内hPGCs和胚胎干细胞(humanembryonicstemcells,hESCs)模型,研究人员建立了hPGC发育的表观遗传学原理:形成素诱导的中内胚层(mesoderm,ME)增强子重塑可以使其瞬时获得hPGC命运;通过CRISPR系统介导的增强子活性修饰,进一步证实了这些增强子在调控介导生殖细胞发育的关键转录因子中的重要性。该研究表明复杂的、增强子调节的转录因子网络支撑hPGC分化和发展。

为了剖析hPGCLC发育的分子基础,作者建立了体外模型来模拟人类原肠胚和生殖细胞的形成【3】。如图1所示,hESCs(等同于植入后外胚层)在经典WNT和ACTIVIN/NODAL信号的作用下可定向分化为ME。12h左右,中内胚层前体细胞(pre-mesoderm,PreME)短暂获得生殖细胞命运能力,并在BMP4刺激下分化为hPGC-样细胞(hPGCLCs);PreME继续发展,形成ME,ME失去了生殖细胞能力但获得明确的内胚层(oderm,DE)和中胚层(mesoderm)命运。在该研究中,作者主要采用RNA-seq、ATAC-seq和超低量染色质免疫沉淀测序(ultralow-inputnativechromatinimmunoprecipitationfollowedbysequencing,ULI-NChIP-seq)检测了hESCs、PreME、ME、DE和hPGCLCs中启动子和增强子相关组蛋白修饰(H3K4me1、H3K4me3、H3K27ac和H3K27me3)状态,并将hPGCLCs与体内性腺hPGCs进行比较。
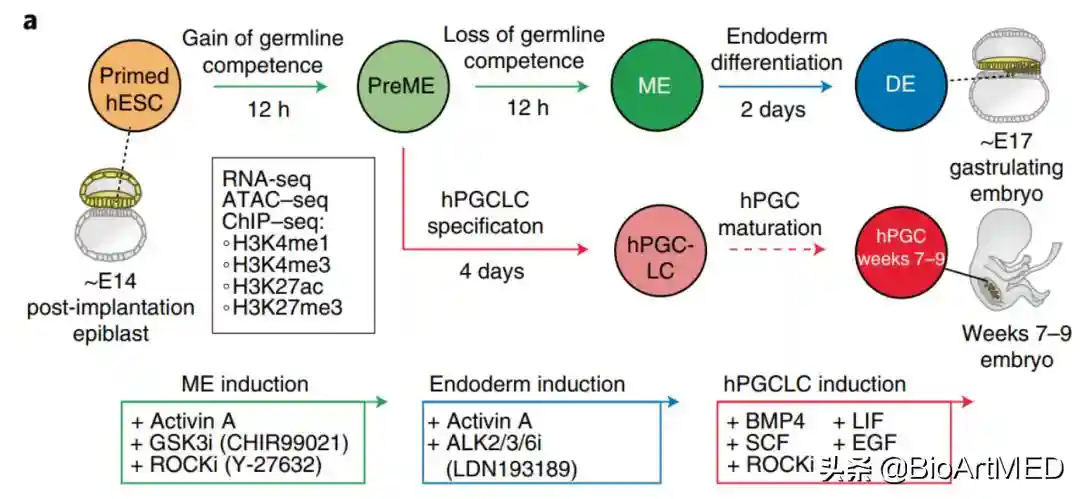
图1.模拟人类原肠胚和生殖细胞形成的体外模型
首先,作者分析了“germline-soma”segregation过程中的表观遗传轨迹(表观遗传动态性)。通过层次聚类分析RNA-seq得到了3个分支:(1)hESCs、PreME和ME;(2)DE和hPGCLCs;(3)hPGCs。除DE细胞外,大多数多能性因子在所有细胞类型中都高表达,而SOX2在ME细胞中表达减少,在hPGCLCs和hPGCs中不表达。ATAC-seq和ULI-NChIP-seq的主成分分析(PCA)将生殖系轨迹沿PC1将hESCs、hPGCLC和hPGCs联系起来,内胚层轨迹沿PC2将hESC、PreME、ME和DE连接起来。这些数据表明表观基因组轨迹与人类原肠胚发育和生殖系建立是一致的。
随后,作者鉴定了体细胞和生殖细胞命运建立过程中的增强子动态活性。根据增强子标志物将增强子划分为五类【7-8】:active、mixed、primed、poised、repressed或neutral。通过追踪增强子对hPGC和DE命运的激活,作者发现hPGCs中40%左右的活化增强子(hPGC-activeenhancers)在hESCs、PreME和hPGCLCs中也处于活化状态(active),而剩余的hPGC-activeenhancers在hESCs中约有1/3处于primed,并在PreME、hPGCLCs或hPGCs中逐渐活化。根据H3K27ac占有率的差异,将21652个增强子分为9类。Cluster1(C1)增强子在hESCs、PreME和ME中具有很强的H3K27ac信号,但在DE和生殖细胞中没有。C1增强子调控的基因编码“developmentalproteins”和“somaticstemcellpopulationmaintenance”,包括SOX2、FGF2和LIF。C6增强子特异性地在DE中活化,并影响参与“odermformation”的基因(例如HNF1B和CXCR4)。C9增强子在hPGCLCs和hPGCs中表现出强H3K27ac信号,与生殖细胞基因相关(例如SOX17、TFAP2C、UTF1、NANOS3和PDPN)。对hPGCLC-activeenhancers进行Motif富集分析表明SOX17、TFAP2C和POU5F1可能活化并维持生殖细胞增强子。
接下来,作者探究了转录因子SOX17、PRDM1和TFAP2C在驱动hPGC命运中的功能。在hPGCLC诱导过程中,SOX17主要作为转录激活因子发挥功能,而PRDM1则是作为转录抑制因子发挥功能。SOX17可以直接上调已知的PGC基因,包括PRDM1、CBFA2T2、TET2、PDPN和CXCR4。SOX17对于hPGC和DE命运建立都至关重要。hPGCLCs中的SOX17co-factors包括POU5F1、NANOG和TFAP2C,DE中包括EOMES、SMAD2/3/4、FOXA1/A2和ZIC2/3/5。在hPGCLCs中,PRDM1直接结合启动子进而抑制基因表达,包括EOMES、ZIC2/3/5和SOX2。SOX17、TFAP2C和PRDM1的唯一共同靶点是NANOS3。TFAP2C-SOX17直接上调/维持核心多能因子POU5F1和NANOG以及转录抑制因子PRDM1和CBFA2T2的表达。有趣的是,TFAP2C促进H3K9去甲基酶KDM4B、KDM4C和ARID5B的上调,触发hPGCs中H3K9me2的去甲基化和染色质的重组。综上所述,SOX17和TFAP2C激活或维持关键TFs(PRDM1、POU5F1和NANOG)的表达,反过来,这些TFs与SOX17、TFAP2C和表观遗传学重塑因子合作,以塑造染色质景观走向hPGC命运。
为了进一步探究驱动hPGC命运获取的最上游表观遗传事件,作者分析了7个高可信度的活化增强子(SOX17和TFAP2C各3个,PRDM11个)。通过CRISPRactivation(CRISPRa)系统(图2b),在hESCs中单独激活SOX17enhancer1和2,可以显著诱导SOX17;同时激活SOX17的所有enhancer时,SOX17的mRNA和蛋白可以上调>10,000倍。更重要的是,共同激活SOX17的启动子和增强子,SOX17将上调60,000倍左右。同时激活TFAP2C的3个增强子足以显著上调TFAP2C的mRNA和蛋白水平,再激活启动子可进一步上调TFAP2C。通过构建CRISPRinterference(CRISPRi)系统(图2a)抑制SOX17的启动子,hPGCLC的诱导效率会降低80%;抑制enhancer1和2,hPGCLC的诱导效率减少60-75%。这些数据证实启动子和增强子在hPGC分化中具有关键调节作用。值得注意的是,通过CRISPRa系统联合只激活SOX17、TFAP2C和PRDM1的启动子或同时激活它们的增强子足以从PreME细胞诱导hPGCLCs,而不需要BMP4,表明通过顺式作用元件激活可建立后生动物生殖细胞。
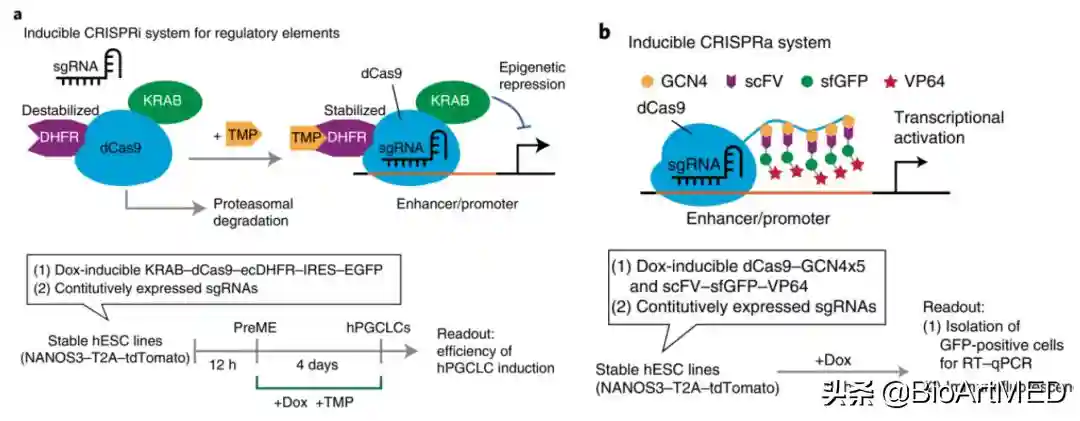
图2.CRISPRi(a)和CRISPRa(b)系统图示
最后,作者探究了如何从PreME中瞬时获得生殖细胞命运。作者提出了一个假设——hPGC分化调控因子的顺式作用元件处于瞬时启动(transientlyprimed)或准备启动(poisedforactivation)的状态。出人意料的是,SOX17、PRDM1和TFAP2C的增强子和启动子在hESCs、PreME和ME中都处于primed或poised状态。在hESC和ME中没有SOX17上调,那么激活SOX17增强子是否可以从hESCs中诱导hPGCLCs?通过CRISPRa激活SOX17增强子,同时联合BMP,作者成功地从hESCs中诱导了hPGCLC。更有意思的是,在PreME中激活SOX17增强子的同时添加BMP4具有协同作用。接下来,作者分析了在ME分化过程中增强子的动态激活,分为“早期”和“晚期”ME增强子。早期ME增强子缺乏H3K27ac,在hESCs中相对难以接近,但在PreME和ME中变得越来越开放,并获得H3K27ac,进而被FGF和经典WNT信号通路下游因子激活。晚期ME增强子仅在ME中变得易接近并获得H3K27ac,其染色质在DE中进一步开放和激活。值得注意的是,OTX2motif在晚期ME增强子中被明确丰富,表明其主要受到晚期METFs的调控。在许多PreME细胞中,与hESCs和ME相比,OTX2表达水平降低,而EOMES表达相对于hESCs显着增加。通过CRISPRi系统进一步减少PreME中的OTX2可以显著提高PGCLC诱导效率。
综上所述,该研究展示了在hESC到ME的表观遗传启动期间生殖细胞命运的获得与消失机制(图3):在hESCs-PreME过渡期间,内源性FGF和WNT信号激活早期ME增强子和基因(包括EOMES);在缺乏晚期激活的METFs情况下,EOMES水平升高的PreME细胞中OTX2表达减少,PreME获得生殖细胞命运;ME中高水平的OTX2和其他METFs则可消除生殖细胞命运同时促进体细胞命运。该研究提出了一个增强子链接的生殖细胞转录因子调控网络,为我们理解哺乳动物生殖细胞的进化和分化提供理论基础,有助于探索不孕症、生殖细胞癌和体细胞年龄相关疾病的发病机制。
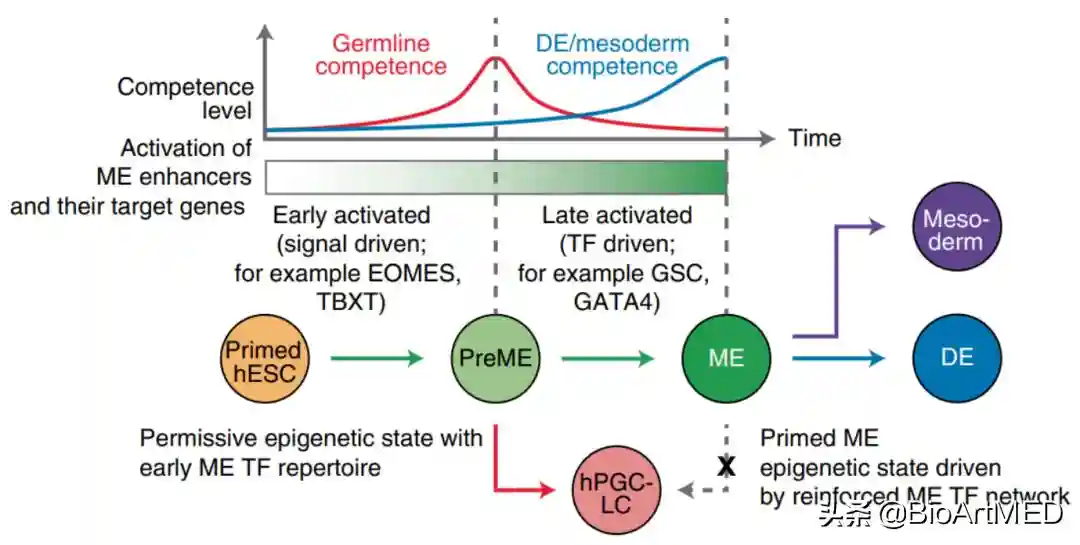
图3.在hESC到ME的表观遗传启动期间生殖系能力的获得与消失
原文链接:
制版人:十一
参考文献
1.Saitou,,,721-735(2016).
2.Saitou,,,721-735(2016).
3.Kobayashi,,416-420(2017).
4.Irie,,253-268(2015).
5.Kojima,,517-532(2017).
6.Sasaki,,178-194(2015).
7.Rada-Iglesias,,279-283(2011).
8.Calo,,:what,how,andwhy?,825-837(2013).
转载须知