哺乳动物胚胎的发生始于一个全能受精卵,逐渐发育成桑葚胚,然后形成囊胚(blastocyst)。囊胚的外胚层(epiblast,EPI)将发育为胚体和羊膜,滋养外胚层(trophectoderm,TE)和原始内胚层(primitiveoderm,PE)则分别发育为胎盘和卵黄囊。TE由滋养层细胞(trophoblasts,TRs)组成,是一种充满液体的上皮胞囊。EPI被不对称地放置在TE胞囊中,其位置定义了第一发育轴polar-mural,也称为embryonic-abembryonic(图1A)。紧邻EPI的TE(polarTE)增殖并自我更新,进而逐渐将胎盘构建成一个复合器官,履行关键功能(例如气体交换、废物排泄和免疫功能);与EPI分离的TE(muralTE)与TE分化、增殖减少以及附着在子宫上的能力有关。因此,囊胚腔的一个功能是分离将形成胎盘或介导初始子宫附着的TRs库。为了应对囊胚植入,子宫细胞增殖并经历功能变化以产生蜕膜。蜕膜为胚胎植入、胎盘发育提供营养和免疫豁免,是子宫内膜基质细胞为适应妊娠而发生的形态学及生理学改变。错误的蜕膜化与不孕和流产有关【1】。
在囊胚中,滋养层细胞的模式化确保了成功的植入和胎盘发育。近日,来自奥地利科学院分子生物技术研究所的团队在CellStemCell杂志在线发表了题为Epiblastinducerscapturemousetrophectodermstemcellsinvitroandpatternblastoidsforimplantationinutero的文章。研究人员鉴定了一组由外胚层分泌的最优诱导剂(FGF4、TGFβ1、IL11、Activin、Bmp7、LPA、8-BrcAMP),可在体外获得稳定、高度自我更新的类似于囊胚期的小鼠滋养外胚层干细胞(trophectodermstemcells,TESCs)。TESCs具有更强的形成胚状体(Blastoids,囊胚样结构)的能力,能在子宫内更有效地诱导蜕膜形成,进而促进胚胎着床。
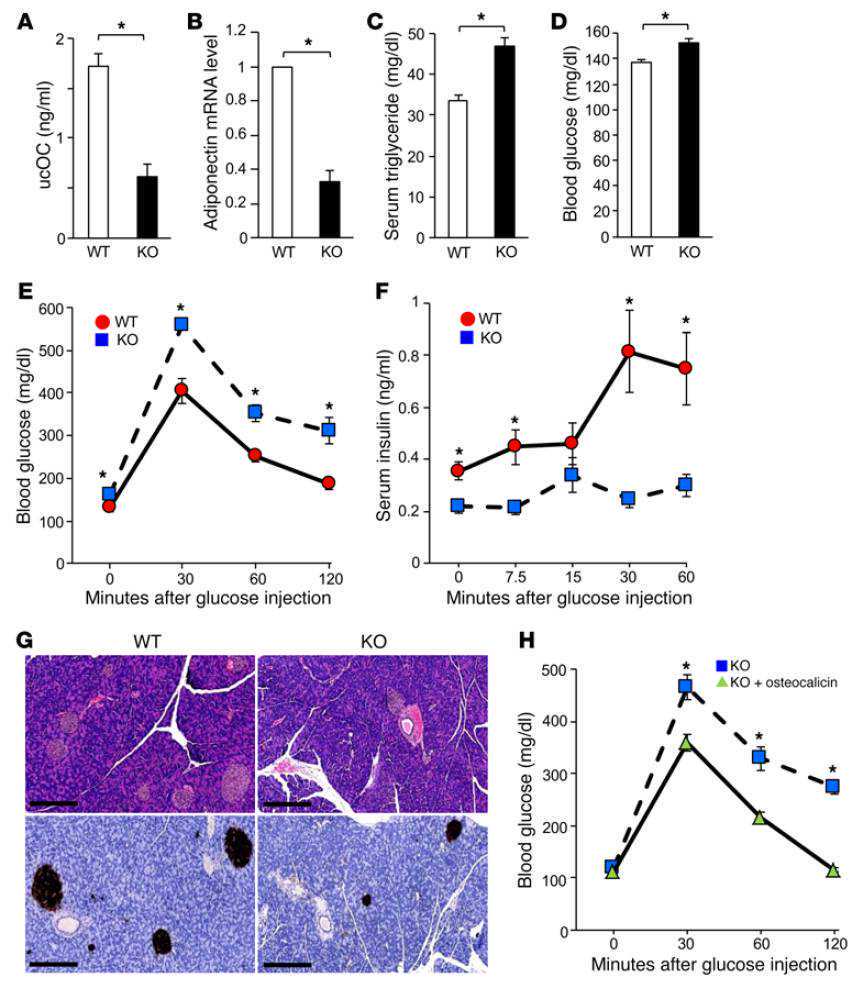
为了探究TRs在不同位置、植入前后的区别,作者首先使用单细胞mRNA测序(scRNA-seq)数据【2】对细胞进行分析,发现polarTE和muralTE转录组存在明显差异(图1)。PolarTE中调节TR自我更新的TFs(Cdx2、Esrrb和Elf5)、Wnt配体Wnt7b和BMP1/4/8b和受体Il6st增加;调节TR增殖的通路和基因上调,包括MAPK通路(Fgfr1、Mapk1、Map2k1、Grb2和Spry2)和增殖机器(Cdk1、Ccnb1-2、Ccnd1、Mki67和Pcna);SMAD信号通路的效应子(E2f4、Smad3、Smad4和Smad7),以及调节Cdx2的Hippo通路成员(Amot、Lats2、Ywhab和Wwc1)和靶标(Max、Myc和Ccnd1)也上调。这些数据表明,STAT、SMAD和Hippo通路在polarTE中得到了增强。而MuralTE的特征包括与中间细丝(Krt8/18)和紧密连接(Ocln、Pard3和Pard6b/g)形成相关的分子以及转录因子Gata2、Klf4/5/9、Tfap2a和Tcf7l2。随后,作者比较了TE()和ExE(extraembryonicectoderm,胚外外胚层,,植入后)TRs的转录组【3】,发现分泌配体Bmp4和Igf2的表达增加,而与胰岛素信号传导相关的基因表达减少。
图1.PolarTE与MuralTE细胞转录组差异分析
接下来,作者探究了滋养层干细胞(TRstemcells,TSCs)的异质性。通过对CDX2high(CDX2在晚期小鼠囊胚中标记polarTE)和CDX2lowTSCs进行RNA-seq,鉴定了1941个差异表达基因。CDX2highTSCs中富集了调控自我更新的TFs(Esrrb、Eomes和Eif5)、细胞周期组分、Hippo通路和一些极性标志物(Ly6a和Ddah1);相反,CDX2lowTSCs高表达分化标志物Krt8和Gata2。通过scRNA-seq分析来描述TSC的异质性,显示TSCs存在三个亚群(cluaster3、4和5):Cluster4富集了TE相关基因,包括与上皮细胞相关的基因(Cldn4/6、Krt18、Epcam、Ctnna1、Lgals9、Krt8/18和Itga6);Cluster3富集了ExE基因(Eomes、Elf5、Hand1、Tead2、Id1、Cited2和Bmp4);Cluster5基本没有TE和ExE基因,反映了更多分化的TRs。因此,TSCs包含3个亚群:滋养外胚层、胚外外胚层和分化的滋养层。这些TSCs亚群反映了功能不同且可互换的干细胞状态:CDX2high细胞存在于细胞周期的所有阶段,而CDX2low细胞主要存在于G0/G1期;CDX2high细胞的致克隆率是CDX2low细胞的3倍,CDX2low细胞在去除FGF4/TGFb1后更容易分化;在CDX2high或CDX2low细胞分选后5天内,这些亚群重新建立了初始异质性。
进一步,作者通过检测EPI分泌因子在TSCs中诱导CDX2的能力,筛选到一组可诱导产生稳定的CDX2highTSCs的最优分子(EPI诱导剂):FGF4(25ng/mL)、TGFb1(2ng/mL)、Activin(50ng/mL)、IL11(50ng/mL)、BMP7(25ng/mL)、8-BrcAMP(200nM)、LPA(5nM)(简称TXV)。在TXV中培养TSCs(1)增强了它们与TE的转录组相似性;(2)增强了自我更新;(3)抑制了与分化相关的基因表达;(4)保持了其快速分化和嵌合ExE的潜力;(5)具有增强的潜力来复刻TE上皮形态发生的特征。因此,作者将这些细胞称为滋养外胚层干细胞(trophectodermstemcells,TESCs)。随后,作者发现EPI诱导剂可局部作用于TEpolar-muralaxis,TESCs具有更强的形成blastoids的能力。
最后,作者探究了EPI诱导剂与蜕膜形成之间的联系。在初始附着(~)之后,囊胚指示子宫形成蜕膜组织(~),但来自不同TRs库的贡献尚不清楚【4】。与TSCs相比,由TESCs或CDX2i-TSCs(CDX2诱导转基因-TSCs)形成的blastoids具有增强的蜕膜化能力,它们形成与囊胚大小相似的蜕膜,表明EPI诱导剂有助于TE进行蜕膜化。用GW501516(PPARd受体激动剂,赋予TE植入能力)处理blastoids,将降低CDX2表达及蜕膜化的可能性,表明CDX2表达赋予TR对子宫组织蜕膜化的能力。随后,作者试图鉴定(1)其分泌受CDX2调节的分子和(2)可能有助于蜕膜化的分子。通过SCENIC计算框架分析,预测了多个Wnt配体(Wnt6和Wnt7b)和受体(Fzd2/7/10),其启动子区域可能与CDX2结合。在囊胚中,Wnt7b转录本最丰富,其次是Wnt6。WNT7B在TE及其衍生物中高表达,Wnt6/7b表达在ExE中保持。由Wnt6或Wnt7bKOTESCs形成的blastoids最初附着在子宫上,与野生型相当(),但发育至时,蜕膜的大小显著减小。这些数据表明,EPI诱导剂不仅维持了局部TR增殖和自我更新,而且促进了WNT6/7B的分泌,刺激子宫蜕膜,有利于胚胎植入。
总的来说,该研究提供了一个框架来解释胎体如何利用诱导和TR状态波动来维持祖细胞、促进分化或分配和平衡植入发生所需的功能(图2)。作者表明EPI诱导剂的特定组合增加了TF网络(CDX2,EOMES和ESRRB)的最优性,增强了自我更新,并防止了分化。而对诱导剂的次优暴露有利于祖细胞状态的波动,从而产生具有促进分化的可逆亚群。这种EPI/TR界面的动态调节赋予祖细胞池一种灵活的策略,以维持更多的祖细胞或产生分化的细胞类型。该研究也存在一定的局限性:(1)由TESCs形成的胚层植入子宫并有效地形成了蜕膜,但并没有观察到胎儿的形成,尚未满足发育的最低要求;(2)基于TSCs中RNA-seq、ChIP、TESC和CDX2过表达分析,以及这些基因在人囊胚TE中的表达模式,选取了WNT6和WNT7b作为CDX2的下游效应子。然而,蜕膜化是一个涉及多个参与者的复杂过程,除了WNT6/7b,胎体分泌的其他分子也可能会影响蜕膜化。
图2
原文链接:
制版人:十一
参考文献
1.Cha,J.,Sun,X.,andDey,(2012).Mechanismsofimplantation:,1754-1767.
2.Nakamura,T.,Yabuta,Y.,Okamoto,I.,Aramaki,S.,Yokobayashi,S.,Kurimoto,K.,Sekiguchi,K.,Nakagawa,M.,Yamamoto,T.,andSaitou,M.(2015).SC3-seq:amethodforhigh,e60.
3.Posfai,E.,Schell,,Janiszewski,A.,Rovic,I.,Murray,A.,Bradshaw,B.,Yamakawa,T.,Pardon,T.,ElBakkali,M.,Talon,I.,etal.(2021).,49-60.
4.Rivron,,Frias-Aldeguer,J.,Vrij,,Boisset,,Korving,J.,Vivie,J.,Truckenmuller,,vanOudenaarden,A.,vanBlitterswijk,,andGeijsen,N.(2018).,106-111.
转载须知