羊城晚报讯记者黄宙辉、通讯员王海芳报道:在我国,乳腺癌的发病率以每年3%的速度增长,已排在我国大城市中女性癌症发病率的第一位。如何更好、更有效地治疗乳腺癌,成为众多科学家科研攻坚的重大课题。经过十余年努力,中山大学孙逸仙纪念医院的宋尔卫教授科研团队(以下简称“科研团队”)发现了乳腺癌转移的新机制,其“乳腺癌转移的调控机制及靶向治疗的应用基础研究”项目获得2015年度国家自然科学奖二等奖。

中山大学孙逸仙纪念医院宋尔卫教授科研团队在北京领取2015年度国家自然科学奖二等奖。图片由该医院提供。
转移是恶性肿瘤主要的致死原因,探索调控肿瘤转移的分子机制,能为临床上筛选诊断标志物早期发现转移,以及研发控制转移的分子靶向药物奠定基础。从1999年开始,科研团队就开始研究非编码RNA及肿瘤微环境调控乳腺癌等恶性肿瘤侵袭转移的分子机制,探索靶向肿瘤细胞导入小分子干扰RNA抑制肿瘤生长转移的有效方法。
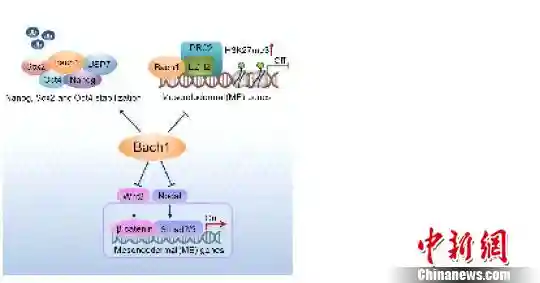
发现微小RNA(miRNA)对肿瘤细胞转移的重要调控机制,是该项目的第一大科学发现。科研团队首次发现let-7等一批miRNA对乳腺癌干细胞分化、上皮-间质转化(EMT)、肿瘤转移和耐药等特性的重要调控作用及其临床价值,为RNA干扰治疗恶性肿瘤提供了新靶点。
发现肿瘤微环境对乳腺癌转移的新调控机制,是该项目的第二大科学发现。“肿瘤细胞就像一颗种子,要生根发芽就需要合适的‘土壤’,也就是肿瘤微环境。”宋尔卫说,科研团队发现,肿瘤相关巨噬细胞(TAM)分泌的趋化因子CCL18是促进乳腺癌细胞侵袭转移的关键因子,并首次成功鉴定了CCL18的功能性受体PITPNM3,揭示CCL18对肿瘤细胞转移信号通路的激活作用,通路中关键节点分子CCL18/PITPNM3可作为抑制肿瘤转移的靶点。此外,该项目还率先论证了体内靶向肿瘤细胞导入siRAN的可行性。
这些基础研究成果要怎样服务于临床?“我们需要找到适合的检测‘套餐’,即能预测乳腺癌复发风险的微小分子RNA模型。”宋尔卫介绍,他们正与中山大学数学系合作,通过利用数学方法建立了一个有10个miRNA的检测套餐模型,以期通过预测结果,判断乳腺癌的复发风险,从而为患者量体裁衣,制定治疗方案。